Highlights des Konzeptpapiers zur Annex 11 Revision
Im Dezember 2022 veröffentlichten das Pharmaceutical Inspection Convention Pharmaceutical Inspection Co-Operation Scheme (PIC/S) und die Europäische Arzneimittel-Agentur (EMA) ein Konzeptpapier zur Revision des Annex 11, um der fortschreitenden Entwicklung von Life-Science-Organisationen und ihrer schrittweisen Umstellung auf neue Technologien gerecht zu werden. Im Folgenden geben wir einen Überblick über alle vorgeschlagenen Ergänzungen und Änderungen sowie deren Auswirkungen auf Ihr Unternehmen.
Was verbirgt sich hinter der Annex 11 Revision?
Annex 11 ist Teil des Eudralex Band 4 und bezieht sich auf computergestützte Systeme. Er enthält Leitlinien für den Einsatz elektronischer Systeme im Rahmen der Guten Herstellungspraxis (GMP). Seit seiner letzten Veröffentlichung im Jahr 2011 haben sich die Life-Science-Organisationen weiterentwickelt, ebenso wie der Einsatz von agilen Methoden, künstlicher Intelligenz, maschinellem Lernen, oder Cloud-Lösungen.
Kurzum: Fortschritt der digitalen Transformation.
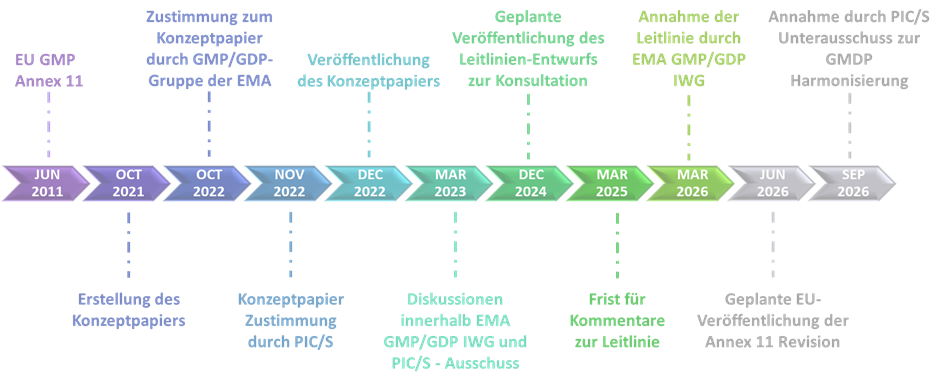
Um der Bedeutung dieser neuen Technologien und den damit verbundenen Risiken Rechnung zu tragen, wurde das Konzeptpapier im Dezember 2022 veröffentlicht, um angemessene regulatorische Leitlinien zu geben. Die 33 Punkte des Konzeptpapiers spiegeln die Struktur und die Kapitel der aktuellen Fassung von Annex 11 (2011) wider und geben einen Überblick über neu aufzunehmende Punkte und zu aktualisierende Themen. Der vorgeschlagene Zeitplan sieht die Fertigstellung und Veröffentlichung der Annex 11 Revision im Juni 2026 vor (Abbildung 1). Die aktualisierte Leitlinie wird sowohl Eudralex Band 4: Annex 11 – Computergestützte Systeme als auch PIC/S PE 009-15: Annex 11 – Computergestützte Systeme ersetzen.
Abbildung1: Vorgeschlagener Zeitplan für die Revision von Annex 11
Welche Neuerungen gibt es?
Die Ergänzungen im Konzeptpapier fördern den Übergang zur digitalen Transformation und den Einsatz integrierter technischer Kontrollen, welche eine wichtigere Rolle bei der Gewährleistung eines geringeren Risikos und verbesserter Compliance während des gesamten Lebenszyklus des Computersystems übernehmen.
Die Notwendigkeit regulatorischer Leitlinien für die Anwendung von künstlicher Intelligenz und Machine Learning Modellen in GMP-Anwendungen wird deutlich. Ebenfalls spielen agile Entwicklungsprozesse (iterative Ansätze) eine zunehmende Rolle, da sie eine größere Flexibilität für Veränderungen bieten.
Ein weiterer wichtiger Aspekt auf den hingewiesen wird, ist der zunehmende Einsatz von Cloud-Systemen. Der wachsenden Bedeutung der Auswahl des richtigen IT-Dienstleisters, wie z. B. Cloud-Service-Provider, wird Rechnung getragen. Die dokumentierte Risikobewertung ist der wesentliche Startpunkt, um die Kritikalität der Anwendung und die damit verbundenen Daten bewerten zu können.
Weiterführend wird auch auf den im September 2022 veröffentlichten Entwurf der FDA-Leitlinien für die Computersoftware-Sicherung für Produktions- und Qualitätssystem-Software (CSA) sowie auf die GCP-Website der EMA verwiesen, die Leitlinien für die gute klinische Praxis (GCP) enthält.
Dem Audit Trail als wichtigem Thema widmet das Konzeptpapier sieben umfangreiche Punkte. Die vorgeschlagenen Aktualisierungen nähern diesen Abschnitt von Annex 11 an andere bestehende Regularien an. Die Bedeutung einer obligatorischen, nicht abschaltbaren Audit Trail-Funktion und eines angemessenen Konzepts zum Audit Trail-Reviews wird bekräftigt.
Als letzten Punkt führt das Konzeptpapier die (Daten-) Sicherheit an. Der schrittweise Einsatz technologischer Lösungen, wie z. B. Cloud-Systeme, birgt zusätzliche Sicherheitsrisiken, weshalb die Vertraulichkeit, Integrität und Verfügbarkeit der Daten und des Systems gemäß ISO 27001 (Informationssicherheit – Cybersicherheit und Datenschutz – Informationssicherheitsmanagementsysteme – Anforderungen) gewährleistet werden muss. Die implementierten Kontrollen und Authentifizierungsmaßnahmen dürfen nur dann Zugang zum System erlauben, wenn der Benutzer mit Sicherheit erkannt wird.
Fazit
Zusammenfassend zielt das Konzeptpapier zur Annex 11 Revision darauf ab, den fortschreitenden Einsatz neuer und anspruchsvollerer digitaler Technologien durch Aktualisierung bestehender und Einführung neuer Kapitel angemessen regulatorisch abzudecken.
Bei Interesse mehr darüber zu erfahren, kontaktieren Sie uns gerne hier.